Azocorante é um tipo de azocomposto que apresentam características colorantes. Sendo assim, a síntese dos azocorantes apresenta o mesmo processo que a síntese de azocompostos. O que caracteriza o azocorante dentre os azocompostos é o tipo de amina utilizada na síntese. A seguir, será apresentada brevemente a síntese de azocompostos, e depois, com maior ênfase, a dos azocorantes.
A síntese de azocompostos, segundo Morrison (2005), ocorre pela reação, em condições apropriadas, de sais de diazonio com certos compostos aromáticos. Esta reação é designada de reação de acoplamento ou de copulação. Por sua vez, os sais de diazônio são produzidos a partir da reação de aminas com ácido nitroso (HONO, ou HNO2).
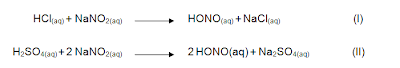
O ácido nitroso é um ácido fraco, instável (SOLOMONS, 2002) e, por causa desta instabilidade (MORRISON, 2005), é sempre preparado in situ, geralmente pelo tratamento de nitrito de sódio (NaNO2) com uma solução aquosa de um ácido forte (SOLOMONS, 2002) mineral diluído a frio (ALLINGER, 1976).
As equações I e II representam a formação do ácido nitroso, utilizando como reagente, o ácido clorídrico (HCl) na primeira e o ácido sulfúrico na segunda. Como produto, além da formação do ácido nitroso, há a formação de cloreto de sódio (NaCl) e sulfato de sódio (Na2SO4), respectivamente nas reações I e II.
Fonte: SOLOMONS, 2002.
O ácido nitroso reage com todas as classes de aminas. Os produtos que obtemos dessas reações depende de a amina ser primária, secundária ou terciária e se a amina é alifática ou aromática (SOLOMONS, 2002) em uma reação conhecida como diazotação (ALLINGER, 1976).
Os produtos da reação de ácido nitroso a frio com aminas primárias variam muito, sendo dependentes da natureza do substituinte orgânico ligado ao nitrogênio. (ALLINGER, 1976).
As aminas alifáticas primárias reagem com o ácido nitroso com formação de sais de diazônio (MORRISON, 2005) alifáticos altamente instáveis que, mesmo em baixas temperaturas, decompõem-se espontaneamente pela perda de nitrogênio para a formação de carbocátions (SOLOMONS, 2002) (Equação III) dando origem a uma mistura complexa de substâncias orgânicas (MORRISON, 2005), que contêm alcoóis, olefinas (alcenos), ciclopropanos (ALLINGER, 1976), e haletos de alquila pela remoção de um próton, reação com água e reação com X– (halogênios) (SOLOMONS, 2002) (Equação IV). Por causa dessa instabilidade, esta reação tem diminuta utilidade em síntese. Todavia, como nela se libera nitrogênio de forma quantitativa, ela tem certa importância em análise, sobretudo de aminoácidos e proteínas (SOLOMONS, 2002).
Fonte: SOLOMONS, 2002.
Fonte: SOLOMONS, 2002.
As aminas secundárias alifáticas (Equação V) e aromáticas (Equação VI) reagem com ácido nítrico para dar compostos amarelos e neutros, as nitrosaminas (R2N – NO) (ALLINGER, 1976).
Segundo Allinger (1976), as aminas alifáticas terciárias reagem de modo complexo em solução fracamente ácida. Quando uma amina alifática terciária é misturada com ácido nitroso, um equilíbrio é estabelecido entre a amina terciária, seu sal e um composto de N-nitrosamônio (SOLOMONS, 2002) (Equação VII) não sendo, esta, uma reação muito importante (ALLINGER, 1976).
Fonte: SOLOMONS, 2002.
Fonte: SOLOMONS, 2002.
As aminas terciárias aromáticas, por sua vez, sofrem substituição anelar, formando compostos em que o grupo nitrosilo (– N = O) aparece ligado ao carbono (MORRISON, 2005) quase exclusivamente na posição para (Equação VIII), se está aberta, e na posição orto, se não estiver (SOLOMONS, 2005).
Fonte: MORRISON, 2005.
Fonte: MORRISON, 2005.
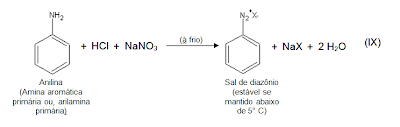
A reação mais importante das aminas, com o ácido nitroso, até agora, é a reação de arilaminas (aminas aromáticas) primárias (SOLOMONS, 2002) tendo grande relevância em sínteses, graças à variedade das reações dos sais de diazônio (ALLINGER, 1976) (Equação IX). Sais de diazônio aromáticos, como o representado na equação IX, também são chamados de sais de arenodiazônio (SOLOMONS, 2002).
Fonte: MORRISON, 2005; SOLOMONS, 2002.
Fonte: MORRISON, 2005; SOLOMONS, 2002.
A diazotação de uma amina aromática primária ocorre através de uma série de etapas (SOLOMONS, 2002), pelo tratamento dessa amina, dissolvida ou em suspensão numa solução aquosa arrefecida de um ácido mineral com nitrito de sódio (MORRISON, 2005), adicionando-se outro reagente a mistura (CuCl, CuBr, KI etc.) à mistura, aquecendo-a brandamente (SOLOMONS, 2002). Como os sais de diazônio se decompõem lentamente, mesmo às temperaturas dos banhos de gelo (MORRISON, 2005) e, sendo muitos sais de diazônio perigosos explosivos em fase sólida, essas soluções são utilizadas imediatamente após a preparação sem que se tente isolar os sais de diazônio (ALLINGER, 1976).
Em presença de ácido forte, o ácido nitroso se dissocia para produzir íons +NO. Estes íons então reagem com o nitrogênio da amina para formar um íon N-nitrosamônio instável como um intermediário. Este intermediário então perde um próton para formar uma N-nitrosamina, que por sua vez, tautomeriza para um diazoidróxido em uma reação que é semelhante à tautomerização ceto-enólica. Então em presença de ácido, o diazoidróxido perde água para formar o íon diazônio (SOLOMONS, 2002) (Figura 07).
Figura 07 – Um mecanismo para a reação de diazotação de aminas aromáticas primárias.
Fonte: SOLOMONS, 2002.
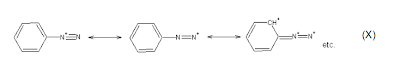
Segundo Sykes (1969) a instabilidade do cátion diazônio, no caso de aminas aromáticas primárias, deve-se a altíssima estabilidade do N2 que pode ser obtido através de sua decomposição, mas, no caso das aminas primárias aromáticas, alguma estabilidade pode ser conferida a este cátion, pois, segundo Reusch (2010), a ligação C – N é mais forte que em aminas alifáticas primárias. Esta estabilidade deve-se ao fenômeno de ressonância representado pela Equação X.
Fontes: SYKES (1969) e REUSCH (2010).
Fontes: SYKES (1969) e REUSCH (2010).
Uma solução aquosa desse íon diazônio tem estabilidade suficiente, entre 0 e 10°C, para que este sal possa ser usado como intermediário em uma variedade de reações (REUSCH, 2010) que podem dividir-se em duas classes: reações de substituição (Tabela 01) e reações de acoplamento (MORRISON, 2005).
Tabela 01 – Reações de Substituição do – N2+ no íon diazônio.
Fontes: ALLINGER, 1976; SOLOMONS, 2002; MORRISON, 2005; REUSCH, 2010 e FOX, 2004.
As reações de substituição que são catalisadas por sais de cobre (I) são conhecidas como Reações de Sandmeyer. A substituição pelo fluoreto ocorre através do tratamento com BF4–. Esta reação é conhecida como Reação de Schiemann (REUSCH, 2010).
Em reações de acoplamento, a anilina é extremamente importante, principalmente na indústria de corantes sintéticos (MORRISON, 2005), por que ela é o composto de partida para a produção de azocorantes, onde os sais de diazônio obtidos pela diazotação da anilina podem atacar outro anel aromático (FOX, 2004), como fenóis, ou mesmo outra anilina formando o azocorante (MINATTI, 2010).
As reações de acoplamento diazo – também chamada de diazocopulação (SYKES, 1969) – são uma reação de substituição eletrofílica que ocorrem entre os sais de arenodiazônio, eletrófilos fracos, com compostos aromáticos altamente reativos, como fenóis e arilaminas terciárias, favorecendo os compostos azo (Figura 08) (SOLOMONS, 2002).
Figura 08 – Representação geral do mecanismo de reação de acoplamento diazo.
Fonte: SOLOMONS, 2002.
Quando o sal de arenodiazônio reage com fenóis ou derivados de anilina, o acoplamento ocorre quase exclusivamente na posição para (Equação XI), se esta estiver aberta. Se a posição para estiver fechada o acoplamento ocorre na posição orto (Equação XII) (SOLOMONS, 2002).
Fonte: SOLOMONS, 2002.
Fonte: SOLOMONS, 2002.
Fonte: SOLOMONS, 2002.
Fonte: SOLOMONS, 2002.
OBSERVAÇÕES:
O artigo postado a aqui é parte de uma Monografia elaborada por Érica de Liandra Salvador para a obtenção do título de especialista em Química [lato sensu].
Clique aqui para acessar a referência da monografia e um link que disponibiliza a versão completa da mesma, assim como outras informações...
REFERÊNCIAS
ALLINGER, Norman L.; et al. Química Orgânica. Trad. Ricardo Bicca de Alencastro, Jossyl de Souza Peixoto, Luiz Renan Neves de Pinho. ed. 2, Rio de Janeiro: LTC, 1976.
FOX, Marye Anne; WHITESELL, James K. Organic Chemistry. 3 ed. Mississauga (Canadá): Jones and Bartelett Publishers, 2004.
MINATTI, Edson. Corantes: A química nas cores. QMCWEB [online], ano 4, Florianópolis. Disponível em http://www.qmc.ufsc.br/qmcweb/artigos/dye/corantes.html. Acesso em 08 de out. 2010.
MORRISON, Robert T.; BOYD Robert N. Química Orgânica. Trad. M. Alves da Silva. ed. 14, Lisboa: Fundação Caloustre Gulbenkian, 2005.
REUSCH, William. Virtual Textbook of Organic Chemistry. Michigan State University – Department of Chemistry, Michigan, 2010. Disponível em: http://www2.chemistry.msu.edu/faculty/reusch/VirtTxtJml/intro1.htm;. Acesso em: 24 out. 2010.
SOLOMONS, T. W. Graham; FRYHLE, Craig B. Química Orgânica. Trad. Whei Oh Lin. v. 2, ed. 7, Rio de Janeiro: LTC , 2002.
SYKES, Peter. Guia de Mecanismos da Química Orgânica. Trad. Wiktor Wajntal; Rev. Andrejus Korolkovas. Rio de Janeiro: LT, 1969.










Nenhum comentário:
Postar um comentário