Os isótopos de muitos elementos são radioativos, o que significa que os elementos espontaneamente se transformam em outros elementos. Cada isótopo radioativo tem sua própria meia-vida, que é o tempo que a metade da concentração do isótopo leva para se transformar em outro elemento. Após duas meias-vidas, um isótopo radioativo é reduzido a ½ x ½ ou ¼ de sua concentração.
Gráfico 1 - Transformação do urânio em chumbo.
Fonte: Referências: COMINS, Neil F., KAUFMANN III
Entre os mais importantes elementos radioativos para se determinar a idade dos objetos em
astronomia está o isótopo do urânio com 146 nêutrons, 238U (urânio duzentos e trinta e oito). A meia-vida do 238U quando decai em chumbo é de 4,5 bilhões de anos.Para determinar em que época um objeto (por exemplo, um pedaço de restos espaciais descoberto na Terra) se solidificou, os cientistas estimam a quantidade de urânio e chumbo que ele contém agora. Subtraindo a quantidade de chumbo original, eles usam a quantidade de urânio e chumbo, juntamente com o gráfico de decaimento radioativo, para determinar a idade do objeto.
Exemplo: Suponha que foi determinado que um pedaço de restos espaciais possuísse a mesma quantidade de chumbo e urânio. Quanto tempo atrás este fragmento se formou? Supondo que originalmente ele não tinha chumbo, podemos ver pelo gráfico que a mistura de 1 para 1 de chumbo e urânio ocorreu a 4,5 bilhões de anos depois que o objeto se formou. Esta é a meia-vida do urânio.
Este processo funciona com qualquer isótopo radioativo. Entretanto, alguns isótopos têm meias-vidas muito curtas e assim não são úteis em astronomia. Por exemplo, a bem conhecida datação por carbono usada para determinar as idades de artefatos antigos na Terra é de pouco uso em astronomia porque o 14C tem uma meia-vida de apenas 5.730 anos. Como muito do carbono em uma amostra terá decaído, a datação usando carbono é útil em intervalos de tempo menores do que 100 mil anos, um período que é pequeno para a maioria dos fenômenos de importância astronômica.
O carbono-12 é o principal isótopo do carbono, mas existe uma proporção pequena de carbono-14 em todos os seres vivos. Seus núcleos são produzidos quando os núcleos de nitrogênio da atmosfera são bombardeados pelos nêutrons formados nas colisões de raios cósmicos com outros núcleos:
Os átomos de carbono-14 são produzidos na atmosfera em velocidade aproximadamente constante e a proporção entre o carbono-14 e o carbono-12 na atmosfera tende a permanecer constante com o tempo. Os átomos de carbono-14 são incorporados aos organismos vivos como 14CO2 através da fotossíntese e da digestão. Como resultado, todos os organismos vivos tem uma razão fixa (de cerca de 1 para 1012) entre os átomos de carbono-14 e os átomos de carbono-12, e 1,0 g de carbono natural tem a atividade de 15 desintegrações por minuto.
Quando o organismo morre, não mais ocorre troca de carbono com a vizinhança. Entretanto, os núcleos de carbono-14 que estão no organismo morto continuam a desintegrar-se com uma meia-vida constante; logo, a relação entre carbono-14 e carbono-12 decresce. A razão observada em uma amostra de tecido morto pode, portanto ser usada para estimar o tempo decorrido desde a morte.
Exemplo: Uma amostra de carbono de massa 1,00 g, proveniente de uma árvore encontrada em um sítio arqueológico na Amazônia, produziu 7,9 x 103 desintegrações de carbono-14 em um período de 20,0 horas. No mesmo período, 1,00 g de carbono de uma fonte recente produziu 1,84 x 104 desintegrações. Calcule a idade da amostra arqueológica.
Faz 7.000 anos que o pedaço de madeira deixou de fazer parte da árvore viva.
Referências: Descobrindo o Universo; COMINS, Neil F., KAUFMANN III, William J.; 8ª Edição;Porto Alegre; Editora Bookman; 2010.

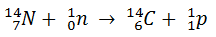

Nenhum comentário:
Postar um comentário